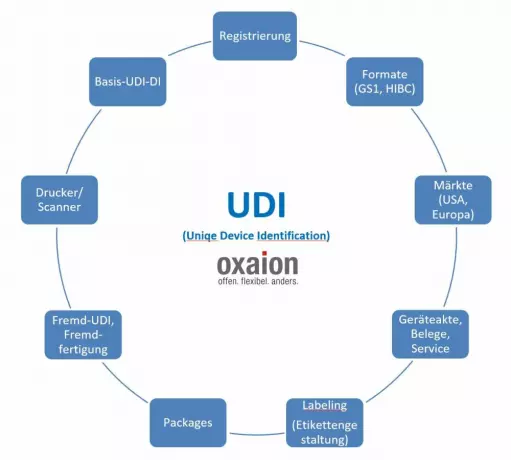
UDI als Teil der Unternehmenssoftware in...
Die UDI entwickelt sich nicht zuletzt durch die MDR zu einem wesentlichen Bestandteil übergreif...
Digitale Medizintechnik-Messe des größten MedTech Clusters Deutschlands

UDI als Teil der Unternehmenssoftware in...
Die UDI entwickelt sich nicht zuletzt durch die MDR zu einem wesentlichen Bestandteil übergreif...

Die benannten Stellen für MDR und IVDR sind dieselben und haben ihren Sitz in den Vereinigten Staaten und der Europäischen Union. Sie werden vom British Standards Institute benannt. Die Stellen sind für die Bewertung von Medizinprodukten und die Zertifizierung ihrer Sicherheit und Wirksamkeit zuständig. Die benannten Behörden sind unabhängig und arbeiten nicht für die FDA oder eine andere Regulierungsbehörde. Sie beraten auch zu den wissenschaftlichen Nachweisen, die für die Bewertung eines Medizinprodukts erforderlich sind.
Die Zahl der von MDR und IVDR benannten Behörden ist in den letzten 18 Monaten erheblich gestiegen, aber es gibt immer noch eine große Anzahl kleinerer regionaler Benannter Stellen ohne großen Kundenstamm. Einige von ihnen haben öffentlich erklärt, dass sie keine MDR- und IVDR-Bezeichnungen beantragen werden. Nichtsdestotrotz bemüht sich die Kommission um mehr MDR- und IVDR-benannte Stellen, selbst wenn ihre Kunden klein und nicht vertreten sind.
Was die MDR betrifft, stehen Hersteller vor vielen Herausforderungen. Erstens sollte die Verordnung nicht so komplex sein wie heute. Die zweite Richtlinie tritt 2022 in Kraft, was bedeutet, dass die Frist für MDR und IVDR noch einige Jahre entfernt ist. Die Umsetzung der Richtlinien wird daher eine große Herausforderung für die Medizinprodukteindustrie. Zweitens kann ein Mangel an MDR-Benannten Stellen verhindern, dass viele Geräte rechtzeitig zum Go-Live-Datum der MDR zertifiziert werden.
Die MDR/IVDR wird tiefgreifende Auswirkungen auf Medizingeräte- und Diagnostikunternehmen haben. Um der Konkurrenz einen Schritt voraus zu sein, ist es für Hersteller von entscheidender Bedeutung, über die richtige Geschäftsstrategie zu verfügen. Wenden Sie sich für weitere Informationen an die Experten von ICON. Diese Fachleute können Ihnen dabei helfen, eine solide Geschäftsstrategie umzusetzen und sich im komplexen regulatorischen Umfeld zurechtzufinden. Diese Spezialisten sind die perfekte Ressource, um Sie durch den schwierigen Weg zu führen, der vor Ihnen liegt. Sie werden Ihre Entscheidung, ihre Hilfe in Anspruch zu nehmen, nicht bereuen.
Die von MDR und IVDR benannten Stellen sind für die Bewertung von Medizinprodukten zuständig. Die neuen Vorschriften verlangen von den benannten Stellen eine umfassendere klinische Nachbeobachtung und Überwachung nach dem Inverkehrbringen. Der Prozess ist kompliziert und erfordert mehr Investitionen als in der Vergangenheit, aber er spart Ihnen Geld und Zeit. Es ist entscheidend, so schnell wie möglich die richtige Anleitung zu erhalten. Die Übergangsplanung ist unerlässlich. Der nächste Schritt besteht darin, die geeigneten MDR- und IVDR-Behörden zu identifizieren.
Die von MDR und IVDR benannten Stellen haben unterschiedliche Verantwortlichkeiten. MDR wird das umfassendste von allen beiden sein und die Anforderungen sowohl für IVDR- als auch für MDR-Geräte abdecken. Die Verordnungen werden auch die Qualität dieser Medizinprodukte regeln. Diese Experten gewährleisten die Qualität und Sicherheit der Medizinprodukte. Die MDR und IVDR sollen gefährliche Praktiken in der EU verhindern. Trotz dieser Unterschiede sind die Ziele der beiden Verordnungen dieselben: Um die Zahl der Patienten mit Nebenwirkungen zu reduzieren, werden MDR und IVDR effektiver.
Werden Sie selbst digitaler Aussteller im Online-Portal der größten und bekanntesten MedTech Cluster Region Deutschlands und informieren Sie die Welt der Medizintechnik über Ihre Produkte und Dienstleistungen sowie über News, Events und Karrieremöglichkeiten.
Mit einem ansprechenden Online-Profil, helfen wir Ihnen dabei sich professionell auf unserem Portal sowie in Google und in den sozialen Medien virtuell zu präsentieren.