
Endotoxintest (gemäß USP 85 und Ph. Eur....
Endotoxine (altgriechisch endo: „innen“, „innerhalb“, toxíne, „...
Digitale Medizintechnik-Messe des größten MedTech Clusters Deutschlands

Endotoxintest (gemäß USP 85 und Ph. Eur....
Endotoxine (altgriechisch endo: „innen“, „innerhalb“, toxíne, „...

Prüfungen im Rahmen der Validierung von Anleitungen...
Hersteller oder Inverkehrbringer von Medizinprodukten, die zur Wiederverwendung vorgesehen sind, m&u...

Prüfungen im Rahmen der Validierung von Anleitungen...
Analog zur Aufbereitung von Medizinprodukten (Reinigung und Desinfektion) muss der Hersteller oder I...
Biologische Sicherheitsprüfung von Medizinprodukten
Biologische Prüfung von Medizinprodukten / Biokompatibilität Tentamus Pharma & Med...

ENDONEXT™ Bakterielle Endotoxin-Tests
Die Zukunft des Endotoxin-Nachweises hat begonnen! Für eine umfassende Pyrogen-Teststrategie...
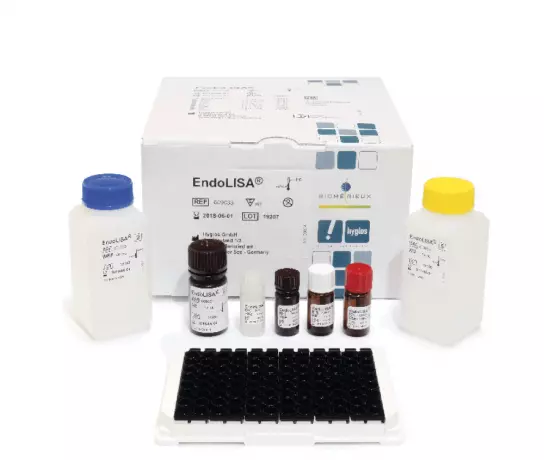
ENDOLISA® (Endotoxin-Nachweis)
Hebt die Einschränkungen konventioneller Methoden, wie Inhibition und Verstär...
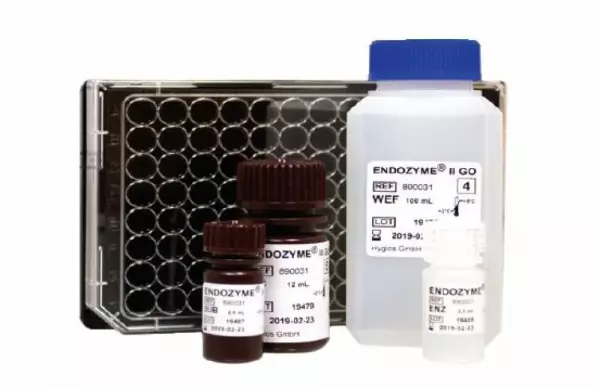
ENDOZYME® II GO (Endotoxin Test)
WICHTIGSTE VORTEILE: Endpunkt Fluoreszenz-Assays im 96-Well-Mikrotiterplattenformat mit Ver...

Bakterielles Endotoxin & Pyrogene: Monozyten...
TPMD ist akkreditiert und GMP zertifiziert für Bestimmung von bakteriellem Endotoxin (BET) und...

Endotoxine sind schädliche Chemikalien, die natürlicherweise in der Umwelt vorkommen. Sie können in Wasser, Boden und Luft gefunden werden. Darüber hinaus können sie durch menschlichen Kontakt in die Umwelt freigesetzt werden. Da es wichtig ist, Produkte auf Endotoxine zu testen, müssen Unternehmen diese Tests verwenden, um sicherzustellen, dass sie sicher in der Anwendung sind. Diese Methoden verleihen den Produkten auch Integrität und stellen sicher, dass ihre Inhaltsstoffe frei von Verunreinigungen sind. Um festzustellen, ob ein Produkt Endotoxine enthält, werden die folgenden Schritte verwendet.
LPS kann auch ohne lebensfähige Bakterien jahrelang in der Umwelt verbleiben. Dies macht Endotoxintests für die Sicherheit von Arzneimitteln und Medizinprodukten unerlässlich. Das LPS-Molekül selbst ist jedoch variabel. Um herauszufinden, was der Ursprung des LPS-Moleküls ist, sind weitere Studien erforderlich. Deshalb ist es wichtig, Endotoxin-Tests zu verwenden. Inzwischen kann die LER-Prüfung als zuverlässige Methode zur Gewährleistung der Sicherheit von Arzneimitteln und Medizinprodukten eingesetzt werden.
Endotoxintests sind für Hersteller von Medizinprodukten sinnvoll. Diese Tests können feststellen, ob ein bestimmtes Produkt sicher in der Anwendung ist. Die gebräuchlichste Methode besteht darin, die Konzentration von Endotoxinen in einer Blutprobe zu messen. Sie basiert auf der Farbe des Gelklumpens. Der Test beinhaltet die Verwendung von Spektrophotometrie, um die Konzentration der Verunreinigung im Gel zu messen. Die resultierende Farbe des Gerinnsels wird dann analysiert.
Neben der Analyse der Toxizität eines Stoffes können Endotoxintests auch zur Bestätigung der Sicherheit von Medizinprodukten eingesetzt werden. Die FDA hat Richtlinien für die LAL-Tests, die an Arzneimitteln durchgeführt werden. Diese Tests sollten auf einem Enzym basieren, das aus den Hämolymphzellen des Pfeilschwanzkrebses extrahiert wurde. Dieses Verfahren basiert auf der physiologischen Reaktion zwischen Endotoxinen und Amöbozyten. Amöbozyten sind Proteine, aus denen die Zellwände gramnegativer Bakterien bestehen. Diese bakteriellen Endotoxine schädigen die Zellen in einer Gewebekultur und werden ins Blut freigesetzt.
Wenn Endotoxine in Medizinprodukten vorhanden sind, können die darin enthaltenen Bakterien Entzündungsreaktionen hervorrufen und sogar Todesfälle verursachen. Daher verfügt die pharmazeutische Industrie über robuste bakterielle Endotoxin-Testabläufe zum Nachweis dieser pyrogenen Komponenten. Sie haben den Kaninchenpyrogentest durch einen neueren Test namens Limulus-Amöbozytenlysat ersetzt. Sie sind nicht nur hilfreich für Arzneimittelhersteller, sondern auch für die breite Öffentlichkeit.
Andere Endotoxin-Tests neben dem RSE umfassen den Kaninchen-Pyrogen-Test. Dabei wird einem lebenden Kaninchen ein bakterielles Endotoxin injiziert. Der LAL-Test ist eine In-vitro-Methode, während der Kontrollstandard-Endotoxintest ein bakterieller Endotoxintest ist. Es dient zum Nachweis von Bakterien- und Pilzgiften.
Werden Sie selbst digitaler Aussteller im Online-Portal der größten und bekanntesten MedTech Cluster Region Deutschlands und informieren Sie die Welt der Medizintechnik über Ihre Produkte und Dienstleistungen sowie über News, Events und Karrieremöglichkeiten.
Mit einem ansprechenden Online-Profil, helfen wir Ihnen dabei sich professionell auf unserem Portal sowie in Google und in den sozialen Medien virtuell zu präsentieren.