Was brauchen Hersteller von Medizinprodukten, um das empfindliche Gleichgewicht zwischen effektiven Softwarelösungen und der Einhaltung gesetzlicher Vorschriften zu finden? Erfahren Sie, wie ein umfassender, regulierungsorientierter Ansatz für Softwareentwicklung und -test dazu beitragen kann, potenziell kostspielige Geräterückrufe zu vermeiden.
Medizinprodukte sind aus der modernen Gesundheitsversorgung nicht mehr wegzudenken. Sie spielen eine wichtige Rolle bei der Diagnose und Behandlung. Medizinprodukte reichen von Basisgeräten wie Thermometern und Spritzen bis hin zu komplexeren chirurgischen Instrumenten, Herzschrittmachern, Prothesen, Kathetern sowie therapeutischen und diagnostischen Geräten. Diese komplexeren Geräte mit hohem Risiko sind oft dafür verantwortlich, menschliches Leben zu schützen und zu erhalten.
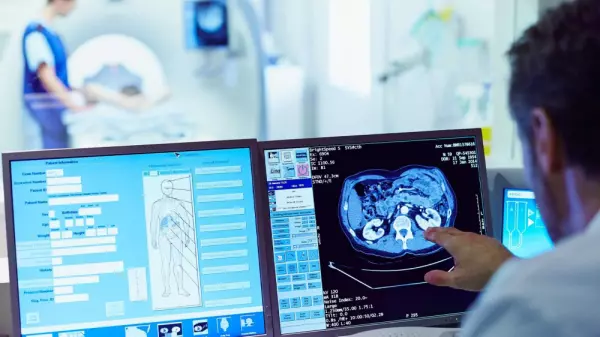
Medizinprodukte sind komplexer geworden und damit auch die Software, die ihr Herzstück bildet. Neben der Steuerung und Überwachung medizinischer Geräte öffnet fortschrittliche Software die Tür zu einer Vielzahl neuer Funktionen und Merkmale.
Die Verwendung von drahtlosen Kommunikationstechnologien bedeutet beispielsweise, dass sich medizinische Geräte mit anderen Geräten, einschließlich Computern und Smartphones, verbinden können. Mit Wearables-Sensoren und maschinellem Lernen ist es möglich, Daten zu sammeln, an einen Arzt zu senden und die Behandlung zu automatisieren. Künstliche Intelligenz trägt bereits zur Verbesserung der diagnostischen Bildschärfe bei. Und dies sind nur einige Beispiele dafür, wie medizinische Software in letzter Zeit das Gesundheitswesen und die medizinischen Geräte verbessert hat.
Diese rasante Entwicklung hat jedoch auch Hersteller, Gesetzgeber und Aufsichtsbehörden vor neue Herausforderungen gestellt.
Erst im letzten Jahr erreichten die Rückrufe von Medizinprodukten Rekordhöhen, wobei Software der häufigste Faktor für Rückrufe war. Tatsächlich sind Softwareprobleme seit 2016 der Hauptgrund für Geräterückrufe.
Es scheint drei Hauptgründe für diesen Anstieg zu geben. Erstens ist die Zahl der Medizinprodukte, die fortschrittliche Software verwenden, jetzt höher. Zweitens benötigt diese Art von Software ständige Updates, die nach der Markteinführung Probleme aufwerfen können. Drittens wächst die Zahl der Variablen in einer klinischen Umgebung, die berücksichtigt werden müssen, wenn Hersteller immer innovativere Software entwickeln.
Da sich die Verbreitung von Hightech-Medizingeräten fortsetzt, werden sich die Herausforderungen mit Software voraussichtlich nicht verringern, insbesondere nicht jetzt, da eine neue medizinische Verordnung auf dem Weg ist.
2017 haben der Europäische Rat und das Parlament die neue Medizinprodukteverordnung (MDR) verabschiedet. Dies tritt im Mai 2020 in Kraft und bringt wesentliche Änderungen mit sich, die für Unternehmen obligatorisch sind. Medizinprodukte können nicht mehr auf den europäischen Markt geliefert werden, ohne die strengen Sicherheitsanforderungen der neuen Vorschriften der Europäischen Union zu erfüllen.
Die bisherige Regulierung hatte die eigene Rolle von Software als Medizinprodukt nicht berücksichtigt. Aber diese neue Verordnung wird dies ändern. Alle Geräte, die Software enthalten, einschließlich medizinischer Apps, die zuvor nicht als Medizinprodukte galten, werden als Medizinprodukt eingestuft.
Hierdurch werden die Hersteller vor neue Herausforderungen gestellt. Die Minimierung von durch Software verursachten Fehlern und Rückrufen bei gleichzeitiger Förderung von Innovationen wird ein empfindliches Gleichgewicht sein. Dies erfordert kontinuierliche Anstrengungen der Hersteller, die einen proaktiven Ansatz verfolgen müssen, um die neue Verordnung zu verstehen und umzusetzen.
Wenn Sie mehr über die Auswirkungen der 2020 in Kraft tretenden Medizinprodukteverordnung erfahren möchten, laden Sie unser kostenloses Whitepaper herunter.
zum Originalartikel